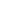
藥品衛生許可證注冊流程
一、藥品衛生許可證注冊的基本要求
藥品注冊標準應當符合《中華人民共和國藥典》通用技術要求,不得低于《中華人民共和國藥典》的規定。申報注冊品種的檢測項目或者指標不適用《中華人民共和國藥典》的,申請人應當提供充分的支持性數據。從事藥品生產活動,應當遵守藥品生產質量管理規范等技術要求,按照國家藥品標準、經藥品監管部門核準的藥品注冊標準和生產工藝進行生產,保證生產全過程持續符合法定要求。
藥品審評中心等專業技術機構,應當根據科學進展、行業發展實際和藥品監督管理工作需要制定技術指導原則和程序,并向社會公布。
二、藥品衛生許可證注冊的申請材料
申請藥品許可證需報送以下資料:
藥品生產國衛生當局簽發的批準該藥品生產和銷售的文本,以及出口證件的復制本,并附中文譯本。
專利品證明文件。
說明書及其中文譯本。
技術資料:
藥品實樣。
包裝材料和標簽樣本。
申請藥品許可證的條件:
- 具備符合國家相關要求的藥品生產企業條件。
- 建立藥品質量保證體系,履行藥品上市放行責任,對其取得藥品注冊證書的藥品質量負責。
三、藥品衛生許可證注冊的審批流程
藥品注冊管理辦法規定,在中華人民共和國境內以藥品上市為目的,從事藥品研制、注冊及監督管理活動,適用本辦法。
新注冊管理辦法實施后,不僅進行了事權調整、藥品注冊分類等調整,還進行了藥品上市許可程序調整。為了讓大家對調整后的藥品上市許可程序一目了然,快速掌握,參照新《藥品注冊管理辦法》,結合自身從業經歷,梳理了藥品上市許可流程圖供各位同仁參考。
不同地區的藥品生產許可證辦理流程可能有所不同,以北京市藥品監督管理局辦理藥品生產許可證為例,工作時限為:受理 2 個工作日、審查與決定 30 個工作日、制證與送達 10 個工作日。
四、藥品衛生許可證注冊的時間周期
目前相關規定中并未明確統一的藥品衛生許可證注冊的具體時間周期。但相較于《藥品注冊管理辦法(2007)》第 4 條規定的針對“治療疑難危重疾病的新藥”實行特殊審批程序,新的《辦法》開辟了更加多元的、以臨床價值為導向的加快上市注冊的程序,包括臨床試驗階段的突破性治療藥物、附條件批準程序、上市許可階段的優先審評審批等。
五、藥品衛生許可證注冊的注意事項
藥品注冊管理辦法的制定是為規范藥品注冊行為,保證藥品的安全、有效和質量可控。
在注冊過程中,要嚴格遵守相關法律法規、規章、標準和規范,保證全過程信息真實、準確、完整和可追溯。
許可事項如經營地址、經營范圍、經營方式、倉庫地址等是需要藥監局去現場實地查驗的事項,而登記事項則可以直接按照申請人提供的營業執照和申請材料就可以確定,不需要實地查驗。

















 辦理資質許可,所屬行業不同,詳情會有所差異,為了精準快速的解決您的問題,建議您向專業的顧問說明詳細情況,1對1解決您的實際問題。
辦理資質許可,所屬行業不同,詳情會有所差異,為了精準快速的解決您的問題,建議您向專業的顧問說明詳細情況,1對1解決您的實際問題。


 相關標簽:
相關標簽:
 瀏覽更多不如直接提問99%用戶選擇
瀏覽更多不如直接提問99%用戶選擇